France CertificationFormation et accompagnement personnalisé pour la mise en place de votre certification
Formation | Accompagnement | Externalisation | Audit interne
France Certification forme et accompagne partout en France les entreprises de toutes les tailles et de tous les secteurs d’activité dans l’obtention et le maintien de leurs certifications. Trouvez celle qui vous correspond.
Ou nous contacter au 0 800 200 268 (appel gratuit)
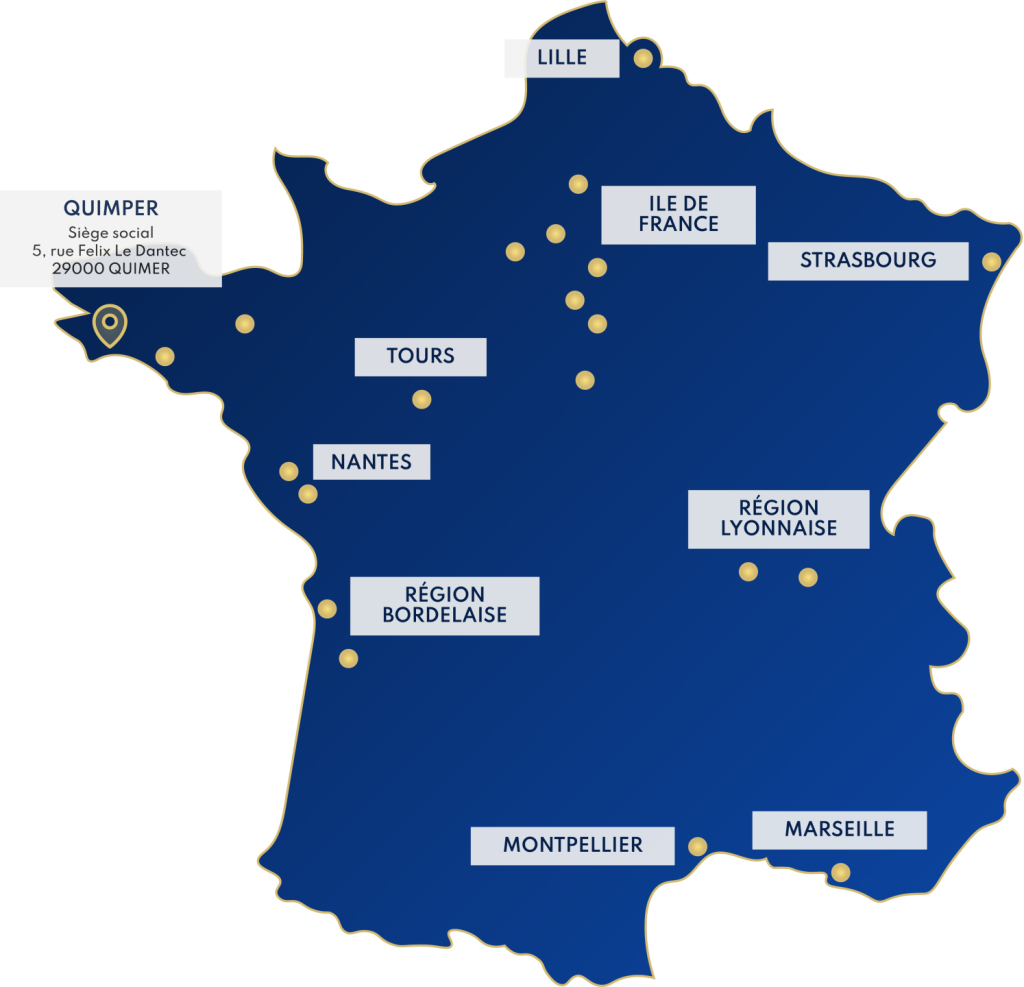
Votre consultant proche de chez-vous, partout en france
Accompagnement sur mesure
Engagement de résultat
Rappel dans la demi-journée
Références clients











0
journées de conseil en 2023
0
score de recommandation client en 2023
0
clients
0
score de satisfaction client en 2023
France CertificationUn accompagnement sur mesure
Entreprise de proximité, France Certification forme et accompagne les entreprises depuis plus de 10 ans dans l’obtention de leur certification.
Leader national ancré en Bretagne, nous intervenons sur quatre champs d’expertise : la formation, l’accompagnement, l’externalisation et l’audit interne.
Notre équipe de consultants, tous salariés, regroupe des compétences et des expertises complémentaires pour vous proposer rapidement des solutions sur mesure adaptées à vos besoins.